現代社會中胰島素抵抗和2型糖尿病等代謝疾病的流行,與人體力勞動和運動的普遍缺乏密切相關[。然而,運動的缺乏在2型糖尿病病理生理中的作用,以及運動如何改善胰島素抵抗,仍困惑着廣大醫學研究人員。
前不久,國際頂級期刊《科學》子刊 Science Advances公佈了澳大利亞莫納什大學Tony Tiganis教授在內分泌和運動醫學領域的一項重磅研究成果。
他們發現,運動通過誘導骨骼肌NOX4表達,促進ROS介導的適應性反應,進而增強肌肉功能,維持氧化還原平衡,逆轉胰島素抵抗。這一發現從氧化應激的角度詳細揭示了運動維持血糖健康的機制,為衰老和肥胖相關的胰島素抵抗提供了一個潛在的治療靶點。

▲Science Advances網站本論文
既往已有多項動物實驗和人群試驗證實運動能促進線粒體生成,增加胰島素敏感性。有研究認為這與運動引起的ROS產生和KEAP1/NFE2L2通路激活有關。
ROS是細胞呼吸的自然副產物,包括H2 O2、O2•−和•OH等,是細胞的內源性氧化劑。運動期間ROS的產生主要由NOX家族催化,其中,NOX4位於骨骼肌細胞,能直接產生H2 O2和O2•−。運動後,ROS氧化KEAP1,導致與KEAP1結合的轉錄因子NFE2L2得以釋放入核,促進線粒體相關基因和抗氧化防禦系統基因的表達。然而迄今為止,詳細機制尚未完全闡明。
於是,Tiganis團隊以NFE2L2和NOX4為突破口,首先檢測了二者在小鼠和人類骨骼肌運動前後的變化情況,發現運動後NFE2L2和NOX4表達上調。考慮到NFE2L2能與NOX4啟動子區域結合,研究人員推斷NOX4是NFE2L2的靶基因,運動通過上調NFE2L2而促進NOX4表達。
為了證明這一推測,Tiganis團隊使用NFE2L2的激活劑——萊菔(lái fú,蘿蔔)硫烷,代替運動刺激NFE2L2,進行細胞和動物實驗,觀察NOX4表達情況。他們發現:成肌細胞和小鼠經萊菔硫烷處理後,NOX4表達升高;而敲除NFE2L2後,萊菔硫烷的處理不能提高NOX4表達。這一結果驗證了他們的猜想。

隨後,Tiganis團隊研究了骨骼肌NOX4缺失對ROS生成的影響,發現敲除成肌細胞的NOX4後,H2 O2生成減少,運動狀態下的 H2 O2激發生成也被消除。這證明ROS生成必需骨骼肌NOX4。此外,特異性敲除小鼠骨骼肌的NOX4後,在ROS生成減少的同時,運動能力和運動耐力也顯著降低。
那麼ROS生成減少和運動能力降低,這兩者之間又是什麼關係呢?考慮到氧化還原酶GPX-1能通過還原 H2 O2來消除ROS,於是,Tiganis團隊沉默了NOX4敲除鼠的GPX-1基因,以抵消NOX4敲除引起的ROS減少。他們發現,敲除GPX-1後,NOX4敲除鼠的運動能力和耐力隨 H2 O2水平恢復了正常。因此,骨骼肌NOX4敲除通過減少 H2 O2生成,而損害運動能力。
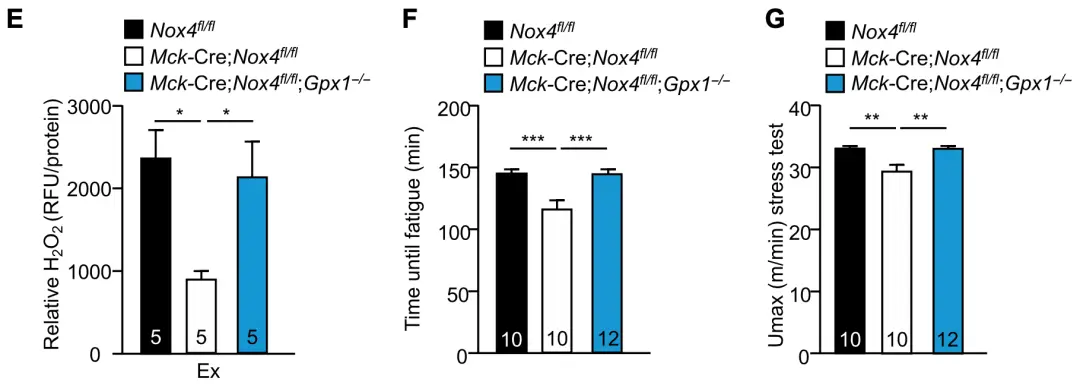
▲圖E:H2 O2在NOX4敲除後生成減少,再敲除GPX-1後可被恢復;圖F和G:鼠運動能力在NOX4敲除後生成減少,再敲除GPX-1後可被恢復。(Nox4 fl/fl為對照用野生型鼠, Mck-Cre; Nox4 fl/fl為實驗組骨骼肌NOX4敲除鼠,Mck-Cre; Nox4 fl/fl,Gpx1-/-為實驗組骨骼肌GPX-1與NOX4雙敲除鼠)
之前有研究表明,運動能力的強弱與骨骼肌線粒體含量的多寡有關[4]。於是,Tiganis團隊對比了GPX-1與NOX4雙敲鼠、NOX4敲除鼠和正常鼠骨骼肌中相關基因的表達情況,發現線粒體生成基因(Pcg1a、Nrf1、Nrf2和Tfam)和線粒體呼吸鏈相關基因,在NOX4敲除後表達降低,在NOX4敲除的基礎上再敲除GPX-1後則表達恢復。這個結果在NOX4敲除的成肌細胞中也得到了驗證,證明骨骼肌NOX4敲除通過降低 H2 O2水平,來抑制線粒體生成,進而損害小鼠的運動能力。
實際上,已有研究發現NFE2L2參與運動誘導的線粒體生成,NFE2L2激活劑萊菔硫烷能增強小鼠運動能力。因此,Tiganis團隊推測:NOX4敲除鼠線粒體生成減少引起的運動能力降低,可能和NFE2L2的缺失有關。
使用萊菔硫烷處理NOX4敲除鼠,發現NOX4敲除引起的NFE2L2表達降低得到糾正,並抑制了線粒體生成相關基因表達的減少。運動耐力檢測發現,萊菔硫烷治療挽救了NOX4敲除鼠運動耐力的下降。
這些發現證明骨骼肌NOX4敲除通過減少 H2 O2,而抑制NFE2L2,進而減弱線粒體生成,最終損害運動能力。
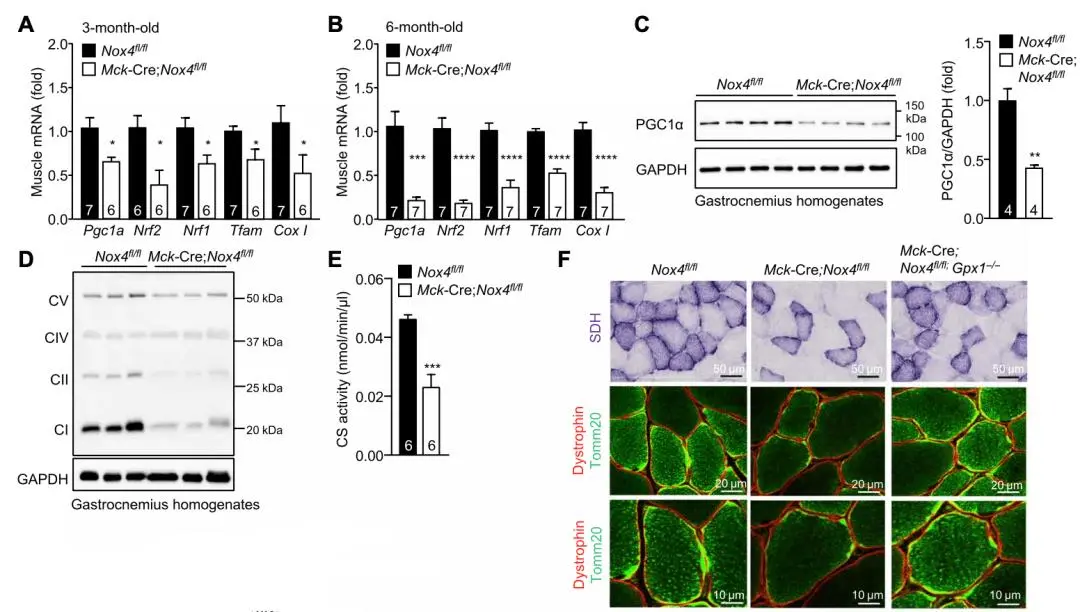
▲圖A-C:線粒體生成基因在NOX4敲除後表達降低;圖D和E:線粒體呼吸鏈相關基因在NOX4敲除後表達降低;圖F:線粒體生成在NOX4敲除後減少(綠色熒光表示線粒體密度)
Tiganis團隊注意到,骨骼肌收縮產生ROS,能增強NFE2L2介導的抗氧化防禦[5]。而且,前期實驗已證明NOX4為肌肉收縮產生ROS所必須。因此,Tiganis和他的同事提出假說:NOX4與抗氧化防禦有關,即NOX4的缺失能導致抗氧化防禦的缺陷。
細胞和動物實驗發現,NOX4敲除引起NFE2L2及NFE2L2靶基因表達的降低,並消除運動對NFE2L2表達的促進作用。無偏蛋白質組學和WB證實,抗氧化防禦基因表達下降(線粒體SOD2、GCLM、PRDX6、NQO1、PRDX1至PRDX3和H2 O2酶),脂質過氧化(4-HNE)、蛋白質氧化和損傷(蛋白質羰基化)和肌肉損傷(CK)等氧化損傷增加。
在NOX4敲除的基礎上再敲除GPX-1以抑制 H2 O2的減少,能大幅度挽救抗氧化防禦基因的表達下降,減輕骨骼肌氧化損傷。因此,骨骼肌NOX4敲除通過減少 H2 O2,來抑制NFE2L2,進而減弱抗氧化防禦,增加氧化損傷。
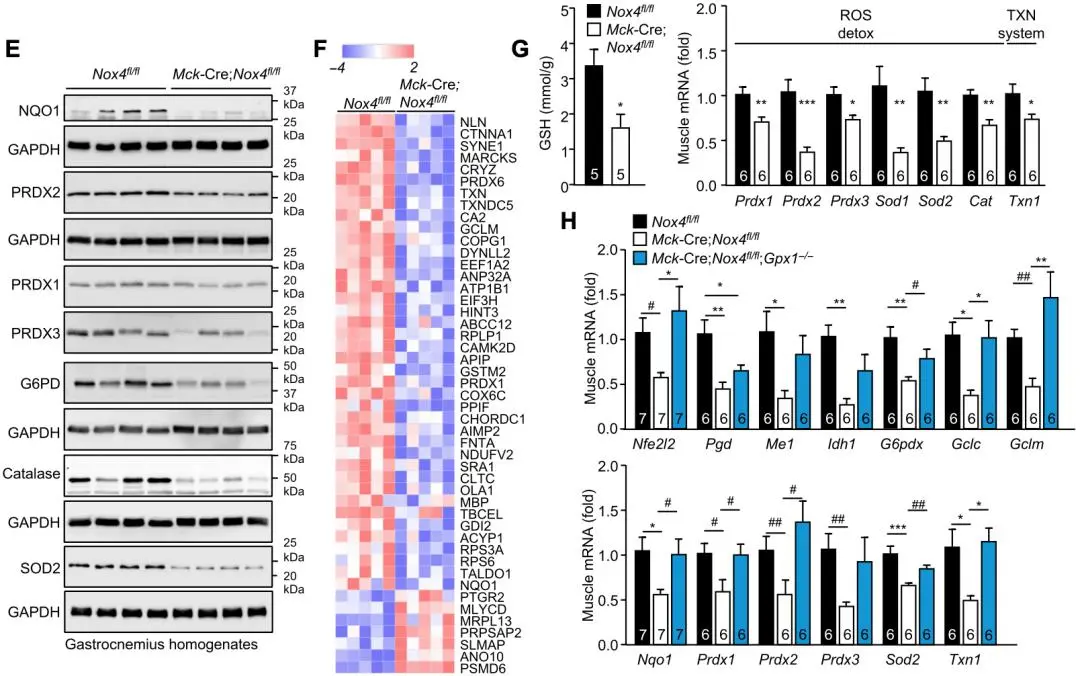
▲圖E(WB)、圖F(無偏蛋白質組學)以及圖G和H(RT-PCR):檢測抗氧化防禦基因在NOX4敲除後表達下降;圖I(4-HNE)、圖J(蛋白質羰基化)和圖K(CK):檢測氧化損傷基因在NOX4敲除後表達上調
鑑於衰老引起的胰島素抵抗和2型糖尿病與氧化損傷有關。基於上述實驗已發現的NOX4/ H2 O2/NFE2L2/抗氧化防禦信號軸,Tiganis和他的同事進一步推測:衰老小鼠的胰島素抵抗可能歸因於NOX4表達的降低。
研究人員比較了衰老鼠和年輕鼠的NOX4表達情況,發現衰老鼠骨骼肌NOX4的表達下降了46%!隨後研究人員還發現NOX4敲除鼠餐後血糖和胰島素水平升高,胰島素反應減弱,骨骼肌對葡萄糖攝取減少,出現胰島素抵抗。對NOX4敲除鼠敲除GPX1以積累 H2 O2,或服用萊菔硫烷以激活NFE2L2,都能逆轉NOX4敲除鼠出現的胰島素抵抗。
肥胖也能通過加劇全身的氧化應激促進胰島素抵抗。Tiganis團隊發現,飲食誘導的肥胖小鼠骨骼肌NOX4表達減少44%!於是,他們大膽推測:NOX4缺乏能加劇飲食誘導肥胖引起的胰島素抵抗。
Tiganis和他的同事評估了高脂飲食催肥後的NOX4敲除鼠的肌肉發育和葡萄糖穩態,發現體重、身體成分和肌肉組織形態無改變,但骨骼肌線粒體生成減少,胰島素抵抗加劇,葡萄糖不耐受程度升高,骨骼肌葡萄糖攝取能力降低,胰島素信號轉導降低(AKT在Ser473的磷酸化水平下降),運動帶來的胰島素增敏效應也減弱。
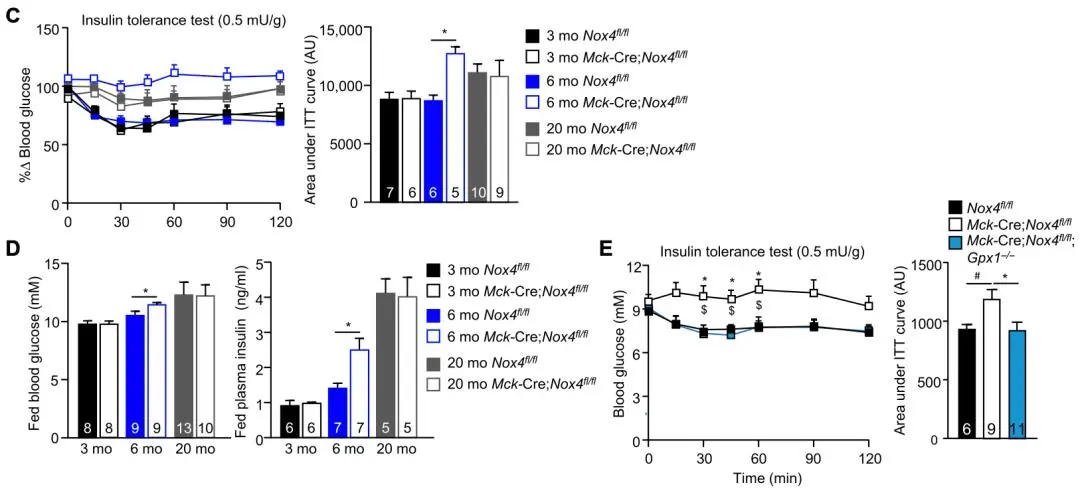
▲圖C和圖E:胰島素耐受試驗發現NOX4敲除後血糖水平升高,胰島素反應減弱;圖D:AKT在Ser473的磷酸化水平經NOX4敲除後下降,予萊菔硫烷(SILF)處理後恢復。
既然線粒體SOD2缺失或線粒體內ROS增加,能降低胰島素信號轉導,促進胰島素抵抗。那麼,NOX4/ H2 O2/NFE2L2/抗氧化防禦信號軸減弱引起的胰島素抵抗是否與此有關呢?
Tiganis和他的同事先對NOX4敲除後的成肌細胞進行了檢測,發現在 H2 O2生成減少和抗氧化防禦基因表達降低的同時,線粒體SOD2蛋白表達降低,線粒體內 O2•−增加,蛋白質羰基化增加,胰島素信號減弱。
而使用萊菔硫烷或敲除KEAP1激活NFE2L2後,蛋白質羰基化降低,胰島素信號恢復。使用線粒體靶向抗氧化劑,SOD模擬物,或線粒體靶向四肽SS31阻斷線粒體 O2•−生成,也能減少蛋白質羰基化,恢復缺陷的胰島素信號。
這些結果表明,NOX4/ H2 O2/NFE2L2/抗氧化防禦/線粒體氧化應激信號軸,在胰島素抵抗的發展中發揮了重要作用。
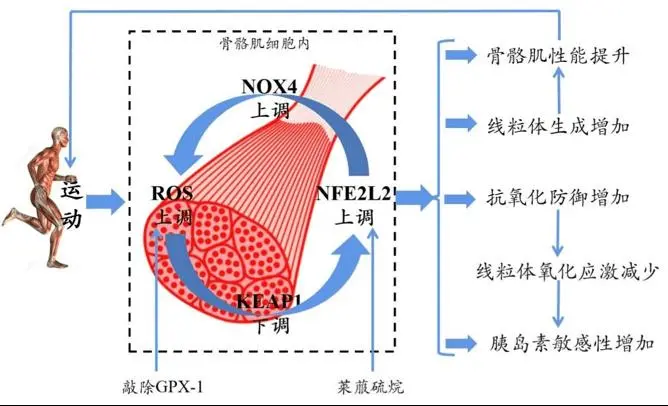
▲論文機制示意圖
科研是一場根據已知尋找未知的尋寶探險,也是一個根據線索補全殘片的拼圖遊戲。從已知的蛛絲馬跡中火眼金睛挖掘線索,爾後大膽假設小心求證,通過精妙設計的實驗,步步為營,撥開未知的迷霧,找到表型的寶藏,發現殘缺的碎片,填補機制的拼圖。Tiganis團隊的這項研究就是如此。
然而,美中不足的是實驗主要圍繞NOX4敲除開展,實驗結論也只是根據NOX4功能缺失後的結果來反推獲得。如果還能結合NOX4功能增強的角度,比如同時也構建NOX4骨骼肌特異性過表達模型,這樣從正反兩面來探究和闡述其在線粒體生成和胰島素抵抗病理生理中的作用,也許會更好。
「管住嘴,邁開腿」,這句防治糖尿病的六字箴言,後半句的重要性超乎想像。所以,為了血糖健康,還不趕緊動起來!